 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
求两电对Fe3+/Fe2+和Hg2+/Hg22+在下列几种情况下的电极电势,并分
析计算
结果。已知
(1) 氧化型浓度增加至10mol·L-1,还原型浓度不变;
(2) 还原型浓度增加至10mol·L-1,氧化型浓度不变;
(3)标准态溶液均稀释10倍。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
结果。已知
(1) 氧化型浓度增加至10mol·L-1,还原型浓度不变;
(2) 还原型浓度增加至10mol·L-1,氧化型浓度不变;
(3)标准态溶液均稀释10倍。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“求两电对Fe3+/Fe2+和Hg2+/Hg22+在下列几种情…”相关的问题
更多“求两电对Fe3+/Fe2+和Hg2+/Hg22+在下列几种情…”相关的问题
A.Cr2O72-和Fe2+
B.Cr2O72-和Cl-
C.Fe3+和Cl-
D.Fe3+和Hg22+
A.升高
B.不变
C.降低
D.电势变化与CN-无关
子强度的影响)。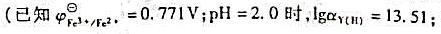
A.稀硫酸
B.盐酸
C.NH4F
D.邻二氮菲
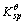 =2.8×10-39,Fe(OH)2的
=2.8×10-39,Fe(OH)2的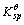 =4.9×10-17。
=4.9×10-17。