 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
有一干燥石材试样,在空气中称得其重量G=222.0g,将其表面用石蜡封涂后其重量G1=223.72g,将其置于水中称重G2=94.0g,石蜡的密度已知为0.86g/cm3,求该石材的表观密度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“有一干燥石材试样,在空气中称得其重量G=222.0g,将其表…”相关的问题
更多“有一干燥石材试样,在空气中称得其重量G=222.0g,将其表…”相关的问题
问题1、向含铜粉的稀硫酸中滴加浓硝酸,写出该反应的离子方程式()。问题2、制备流程中的A操作名称是()。如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中可能存在的杂质是(),除去这种杂质的实验操作称为()问题3、如果采用重量法测定CuSO4-5HO的含量,完成下列步骤。①()②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)。在过滤前,需要检验是否沉淀完全,其操作是()。如果1.040g提纯后的试样中含CuSO•5HO的准确值为1.015g,而实验测定结果是1.000g,测定的相对误差为()问题4、已知:CuSO4+2NaOH→Cu(OH)2↓:1+Na2SO4.称取0.1000g某CuSO4•5H2O试样(杂质不与氢氧化钠溶液反应)于锥形瓶中,加入0.1000mo1/L氢氧化钠溶清28.00mL反府完全后,过量的氢氧化钠用0.1000mo1/L盐酸滴定至格点,托用盐酸20.16mL则0.1000g该试样中含CuSO4•5H2O()g上述滴定中,滴定管在用蒸馏水洗净之后,注入盐酸之前,还需进行的操作是()在滴定中,准确读数应该是滴定管上蓝线()所对应的刻度。
A.从送检样品中均匀取两个平行试样,每个试祥约重 400~600g
B.称得试样重量,在油光纸上将烟把解开,用毛刷逐片正反两面各轻刷 5~8 次,刷净
C.搜集刷下的砂土,通过分离筛,至筛不下为止
D.将筛下的砂土称重,记录重量计算
有一大批糖果.现从中随机地取16袋,称得重量(以g计)如下:506,508,499,503,504,510,497,512,514,505,493,496,506,502,509,496.设每袋重量总体近似地服从正态分布,求:(1)总体均值u的置信度为0.95的置信区间;(2)总体标准差σ的置信度为0.95的置信区间
正极材料为LiCoO2的锂离子电池被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
问题一、橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是()。
②共沉淀反应的化学方程式为()。
③高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后的LiFePO4的导电性能外,还能()。
问题二、废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过以下实验方法回收钴、锂 。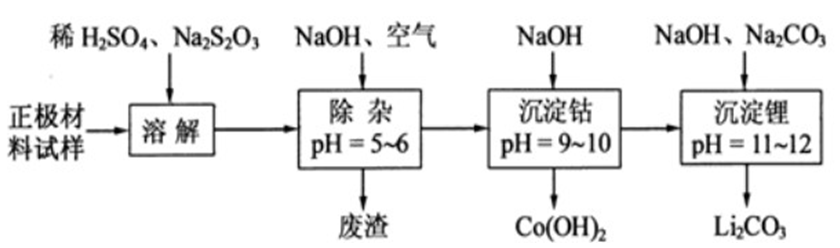
①在上述溶解过程中,S2O32ˉ被氧化成SO42ˉ,LiCoO2在溶解过程中反应的化学方程式为()。
②Co(OH)2在空气中加热时,固体残留率随温度的变化如以下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体成分为()。(填化学式);在350~400℃范围内,剩余固体成分为()。(填化学式) 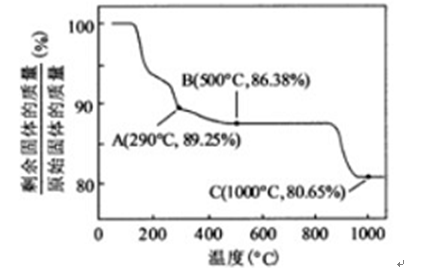
重量分析法用于测定矿石中的磁铁矿(Fe3O4)的含量。称取1.5419g试样,用浓盐酸溶解后,得到Fe2+和Fe3+的混合溶液。加入硝酸将Fe2+氧化至Fe3+,稀释后用氨水将Fe3+沉淀为Fe(OH)3。将沉淀过滤,洗涤和灼烧后得0.8525gFe2O3,计算Fe2O3的质量分数?已知摩尔质量:Fe2O3为159.69g·mol-1Fe3O4为231.55g·mol-1.
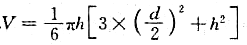 。
。