 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知反应反应=33.(1)计算反应的标准平衡常数Kθ;(2)计算1.0mol·L-1K2CrO4
已知反应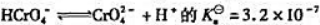 反应
反应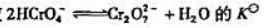 =33.
=33.
(1)计算反应 的标准平衡常数Kθ;
的标准平衡常数Kθ;
(2)计算1.0mol·L-1K2CrO4溶液中CrO42-与Cr2O72-浓度相等时溶液的pH.
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知反应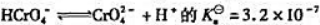 反应
反应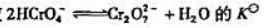 =33.
=33.
(1)计算反应 的标准平衡常数Kθ;
的标准平衡常数Kθ;
(2)计算1.0mol·L-1K2CrO4溶液中CrO42-与Cr2O72-浓度相等时溶液的pH.
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知反应反应=33.(1)计算反应的标准平衡常数Kθ;(2)…”相关的问题
更多“已知反应反应=33.(1)计算反应的标准平衡常数Kθ;(2)…”相关的问题
已知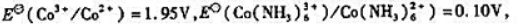
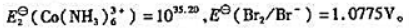
(1)计算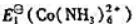 ;
;
(2)写出[Co(NH3)6]2+与Br2(l)反应的离子方程式,计算25℃时该反应的标准平衡常数.
已知反应:

298K时的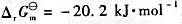 。试计算:
。试计算:
(1)该反应的标准平衡常数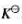 ;
;
(2)若空气中H2S的分压为3.1Pa,试计算可以确保铜单质免遭H2S腐蚀时H2的分压。
已知电极反应:
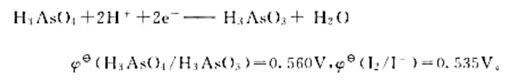
计算下列反应:
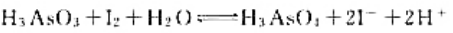
(1)在298K时的平衡常数;
(2)如果pH=7,其他物质浓度均为标准态,反应向什么方向进行?
(3)如果溶液的c(H+)=6.0mol·L-1.其他物质浓度均为标准态.反应向什么方向进行?
已知下列原电池:
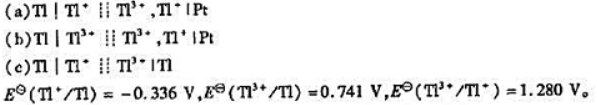
(1)写出各电池反应,并分别指出反应方程式中转移的电子数z;
(2)计算各电池的标准电动势EθMP;
(3)计算各电池反应的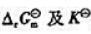 .
.
已知反应:

在45℃时,将0.0030mol的N2O.注入容积为0.50L的真空容器中,系统达平衡时,压力为26.3kPa,试计算:
(1)45℃时N2O4,的分解率及反应的标准平衡常数:
(2)25℃时反应的标准平衡常数;
(3)25℃时反应的标准摩尔熵变;
(4)反应的标准摩尔Cibbs函数变随温度变化的函数关系式.
IZn)=-0.7620V.E-[CI-IAgCl(s)IAgI=0.2222V.电池电动势的温度系数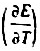 =-4.02x10-4V·K-1.
=-4.02x10-4V·K-1.
(1)写出电池反应;
(2)计算反应的标准平衡常数Kθ;
(3)计算电池反应可逆热Qr,m;
(4)求溶液中ZnCl2的平均离子活度因子ya.
已知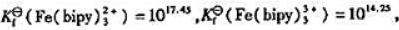 其他数据查附表.
其他数据查附表.
(1)计算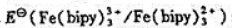 ;
;
(2)将Cl2(g)通入[Fe(bipy)3]2+溶液中,Cl2能否将其氧化?写出反应方程式,并计算25℃下该反应的标准平衡常数Kθ;
(3)若溶液中[Fe(bipy)3]2+的依度为0.20mol·L-1,所通Cl2的压力始终保持100.0KθPa,求平衡时溶液中各离子浓度.
现有KNO3和NaNO2的混合样品5.000g,制备成500.0mL的溶液,移液25.00mL,用浓度为0.1200mol·L-1的Ce4+标准溶液50.00mL在强酸中氧化,过量的Ce4+用浓度为0.02500mol·L-1的Fe2+标准溶液滴定,用去Fe2+溶液28.40mL,相应的反应如下:
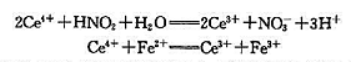
(1)若将第一个反应式作为原电池的电池反应写出该原电池的电极反应并计算该电池反应的ΔrGmθ[已知ϕθ(Ce4++/Ce3+)=1.44V,ϕθ(NO3-/NO2-)=0.934V]
(2)计算试样中NaNO2的质量分数w.[已知M(NaNO2)=69.00g.mol-1]
(3)计算第一步的标准平衡常数Kθ.
解题思路:注意原电池的写法.此题依然是考查电化与热力学、化学平衢间的计算.