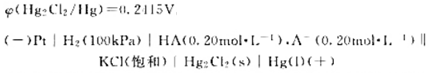更多“一元弱酸HA溶液加水稀释时,HA的解离度增大,但溶液中H3O…”相关的问题
更多“一元弱酸HA溶液加水稀释时,HA的解离度增大,但溶液中H3O…”相关的问题
第1题
已知一元弱酸HA溶液的浓度为c(HA),溶液中HA、A-和H3O+的浓度之和为ac(HA),则HA的解离度a(HA)为().
A.#图片0$#
B.#图片1$#
C.#图片2$#
D.#图片3$#
第2题
已知相同浓度的一元弱酸的钠盐NaA、NaB、NaC和NaD的水溶液的pH依次增大,则在下列相同浓度的四种一元弱酸溶液中,一元弱酸的解离度最大的是().
A.HA
B.HB
C.HC
D.HD
第3题
25℃时,一元弱酸HA的标准解离常数则其他共轭碱A的标准解离常数()。0.010mol·l-1.NaA溶液
25℃时,一元弱酸HA的标准解离常数则其他共轭碱A的标准解离常数()。0.010mol·l-1.NaA溶液
点击查看答案
25℃时,一元弱酸HA的标准解离常数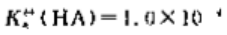
则其他共轭碱A的标准解离常数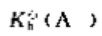 ()。0.010mol·l-1.NaA溶液的pH为()
()。0.010mol·l-1.NaA溶液的pH为()
第4题
称取不纯的未知一元弱酸HA(摩尔质量为82.00g.mo1-1)试样1.600g,溶解后稀释至60.00ml,以0. 2500mol·L-1 NaOH进行电位滴定。已知HA被中和一半时溶液的pH=5.00。而中和至计量点时溶液的pH=9.00.计算试样中HA的质量分数。
称取不纯的未知一元弱酸HA(摩尔质量为82.00g.mo1-1)试样1.600g,溶解后稀释至60.00ml,以0. 2500mol·L-1NaOH进行电位滴定。已知HA被中和一半时溶液的pH=5.00。而中和至计量点时溶液的pH=9.00.计算试样中HA的质量分数。
点击查看答案
第5题
某一元弱酸HA试样1.250g用水溶解后稀释至50.00mL.可用41.20mL 0.09000mol·L-1NaOH滴定至计量点,当加入8.24mL NaOH时溶液的pH=4.30.(1)求该弱酸的摩尔质量(2)计算弱酸的解离常数K和计量点的pH(3)选择何种指示剂?
第10题
由一元弱酸和它的共轭碱NaA组成的缓冲溶液中,HA的浓度为0.25mol·L-1.若在100mL此缓冲溶
由一元弱酸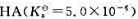 和它的共轭碱NaA组成的缓冲溶液中,HA的浓度为0.25mol·L-1.若在100mL此缓冲溶液中加入5.0mmolNaOH固体,溶液的pH变为5.60。计算加入NaOH固体前缓冲溶液的pH.
和它的共轭碱NaA组成的缓冲溶液中,HA的浓度为0.25mol·L-1.若在100mL此缓冲溶液中加入5.0mmolNaOH固体,溶液的pH变为5.60。计算加入NaOH固体前缓冲溶液的pH.


 如果结果不匹配,请
如果结果不匹配,请