 更多“根据分子轨道理论,指出Cl2的键比Cl2+的键是强还是弱?为…”相关的问题
更多“根据分子轨道理论,指出Cl2的键比Cl2+的键是强还是弱?为…”相关的问题
第2题
已知Cl2分子的键能为242kJmol-1,而Cl原子和Cl2分子的第一电离能分别为1250和1085kJmol-1,试计算Cl2+的键能,并讨论Cl2+和Cl2哪一个键能大,说明理由。
第5题
试根据下列结构信息,用杂化轨道理论分析各分子的成键情况: (1)H2S为“V”字形结构,H-S-H键
试根据下列结构信息,用杂化轨道理论分析各分子的成键情况: (1)H2S为“V”字形结构,H-S-H键
点击查看答案
试根据下列结构信息,用杂化轨道理论分析各分子的成键情况:
(1)H2S为“V”字形结构,H-S-H键角为92°7';
(2)CS2为直线形结构,C原子与两个S原子之间均有双键;
(3)二甲醚(H3COCH3)分子为“V”字形结构,C-O-C键角约为112°;
(4)丙酮(CH3COCH3)的3个C原子和O原子共平面,O-C-C键角和C-C-C键角均接近120°,且碳氧之间存在双键。
第6题
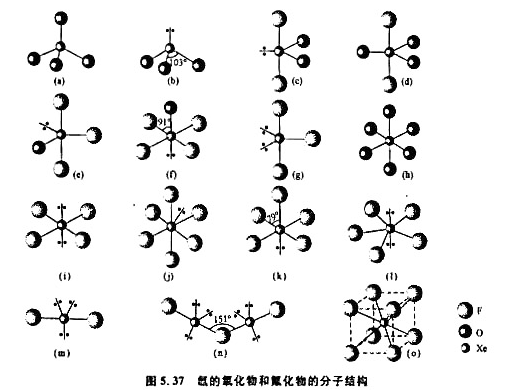
图5.37示出氙的氟化物和氧化物的分子(或离子)结构。(1)根据图形及VSEPR理论,指出分子的几何构型名称和所属点群
图5.37示出氙的氟化物和氧化物的分子(或离子)结构。
(1)根据图形及VSEPR理论,指出分子的几何构型名称和所属点群;
(2)Xe原子所用的杂化轨道;
(3)Xe原子的表观氧化态;
(4)已知在XeF2,XeF4,加合物晶体中,两种分子的构型与单独存在时的几何构型相同,不会相互化合成XeF2,从中说明什么问题?


 如果结果不匹配,请
如果结果不匹配,请 

















