 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件电极电
位。![分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件](https://img2.soutiyun.com/ask/2020-11-16/974370598904697.jpg)
![分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件](https://img2.soutiyun.com/ask/2020-11-16/974370610828379.jpg) 并判断pH=8.0和[H+]=5.0mol/L条件下,下列反应的方向:
并判断pH=8.0和[H+]=5.0mol/L条件下,下列反应的方向:![分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件](https://img2.soutiyun.com/ask/2020-11-16/974370640959102.jpg) 。
。
![分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件](https://img2.soutiyun.com/ask/2020-11-16/974370598904697.jpg)
![分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件](https://img2.soutiyun.com/ask/2020-11-16/974370610828379.jpg) 并判断pH=8.0和[H+]=5.0mol/L条件下,下列反应的方向:
并判断pH=8.0和[H+]=5.0mol/L条件下,下列反应的方向:![分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件](https://img2.soutiyun.com/ask/2020-11-16/974370640959102.jpg) 。
。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
![分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件](https://img2.soutiyun.com/ask/2020-11-16/974370598904697.jpg)
![分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件](https://img2.soutiyun.com/ask/2020-11-16/974370610828379.jpg) 并判断pH=8.0和[H+]=5.0mol/L条件下,下列反应的方向:
并判断pH=8.0和[H+]=5.0mol/L条件下,下列反应的方向:![分别计算25℃时,pH=8.0和[H+]=5.0mol/L条件下,电对H3AsO4/HAsO2的条件](https://img2.soutiyun.com/ask/2020-11-16/974370640959102.jpg) 。
。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“分别计算25℃时,pH=8.0和[H+]=5.0mol/L条…”相关的问题
更多“分别计算25℃时,pH=8.0和[H+]=5.0mol/L条…”相关的问题
已知电极反应:
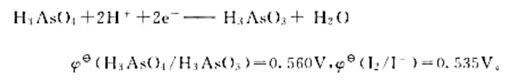
计算下列反应:
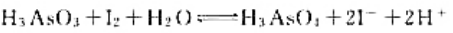
(1)在298K时的平衡常数;
(2)如果pH=7,其他物质浓度均为标准态,反应向什么方向进行?
(3)如果溶液的c(H+)=6.0mol·L-1.其他物质浓度均为标准态.反应向什么方向进行?
试计算25℃时反应

的标准平衡常数.当H2AsO3和I-的浓度为1.0mol·L-1.该反应正、负极电极电势相等时,溶液的pH为多少?