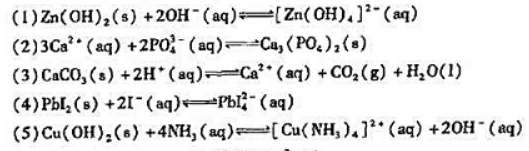更多“计算下列反应的平衡常数,并说明反应进行的方向及计算.”相关的问题
更多“计算下列反应的平衡常数,并说明反应进行的方向及计算.”相关的问题
第4题
已知电极反应:计算下列反应:(1)在298K时的平衡常数;(2)如果pH=7,其他物质浓度均为标准态,反应
已知电极反应:
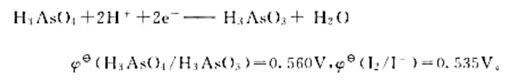
计算下列反应:
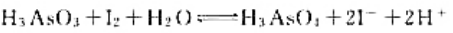
(1)在298K时的平衡常数;
(2)如果pH=7,其他物质浓度均为标准态,反应向什么方向进行?
(3)如果溶液的c(H+)=6.0mol·L-1.其他物质浓度均为标准态.反应向什么方向进行?
第6题
试根据汞的元素电势图回答问题:①在酸性介质中Hg22+能否发生歧化反应?②计算反应的平
试根据汞的元素电势图回答问题:
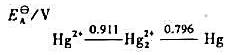
①在酸性介质中Hg22+能否发生歧化反应?
②计算反应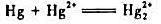 的平衡常数Kθ;
的平衡常数Kθ;
③拟使Hg(I)歧化为Hg(II)和Hg,应该怎样做?试举两个实例加以说明。
第8题
用KMnO4标准溶液滴定Fe2+的反应为:试计算:①该反应的平衡常数;②为使反应完全定量进行
用KMnO4标准溶液滴定Fe2+的反应为:

试计算:①该反应的平衡常数;②为使反应完全定量进行(Fe2+≤10-3[Fe3+]),所需的最低[H+]是多少?(已知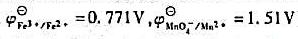 )
)

 .
.

 如果结果不匹配,请
如果结果不匹配,请 
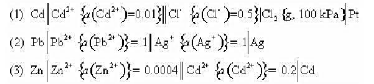
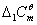 ,并求出解离平衡常数Kθ。
,并求出解离平衡常数Kθ。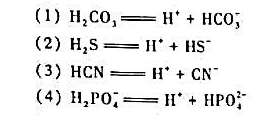
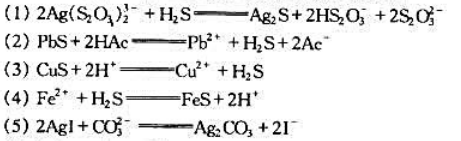
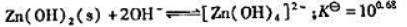
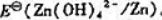 .
.
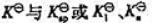 间的关系:
间的关系: