 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
合成氨反应达到化学平衡后,把NH3和H2的分压各增大到原来的2倍,而N2的分压不变,则
A.向正反应方向移动
B.向逆反应方向移动
C.不发生移动
D.无法判断移动方向
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.向正反应方向移动
B.向逆反应方向移动
C.不发生移动
D.无法判断移动方向
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“合成氨反应达到化学平衡后,把NH3和H2的分压各增大到原来的…”相关的问题
更多“合成氨反应达到化学平衡后,把NH3和H2的分压各增大到原来的…”相关的问题
A.升高温度使吉布斯自由能变和和标准吉布斯自由能变均增大
B.升高温度可以使平衡向右移动
C.升高温度可以使平衡常数增大
D.正反应自发时,随着反应进行,N2和H2分压逐渐减小,NH3分压逐渐增大,所以平衡常数Kp逐渐增大
在500K时将 在体积为15.0L的容器内达到下列化学平衡:
在体积为15.0L的容器内达到下列化学平衡: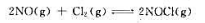 当反应在500K达到化学平衡后测得容器内NaCl的物质的量为3.06mol,计算该温度下NO的平衡物质的量和反应的标准平衡常数。
当反应在500K达到化学平衡后测得容器内NaCl的物质的量为3.06mol,计算该温度下NO的平衡物质的量和反应的标准平衡常数。
A.升高温度可使化学平衡向正反应方向移动
B.#图片1$#
C.反应物的分压等于生成物的分压
D.加入催化剂,可使化学平衡向正反应方向移动
25℃和标准状态下,N2和H2反应生成lgNH2(g)时放出2.71kJ的热量,则(NH3,g,298.15K)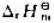 等于()kJ·mol-1.
等于()kJ·mol-1.
A.-2.71/17
B.2.71/17
C.-2.71×17
D.2.71×17
在600℃,100kPa时下列反应达到平衡:
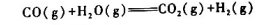
现在把压力提高到5×104kPa,问:
(1)若各气体均视为理想气体,平衡是否移动?
(2)若各气体的逸度因子分别为 (CO2)=1.09,
(CO2)=1.09,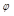 (H2)=1.10,
(H2)=1.10,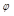 (CO)=1.20,
(CO)=1.20,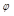 (H2O)=0.75,与理想气体反应相比,平衡向哪个方向移动?
(H2O)=0.75,与理想气体反应相比,平衡向哪个方向移动?
A.CO、NO2 、CO2、NO四种物质的浓度相等
B.反应一段时间后,这四种物质的含量不随时间发生变化
C.CO、NO2 、CO2、NO四种物质在密闭容器中共存
D.正逆反应的速率相等且都为零
生产、合成与制备。
(1)以N2和H2为主要原料制备NH4NO3。
(2)由NH3制备N2H4和HN3。
(3)由NaNO3制备N2O5。
(4)以磷酸钙矿为主要原料生产P2O5和单质P。
(5)完成下列物质转化的化学反应方程式并给出反应条件。
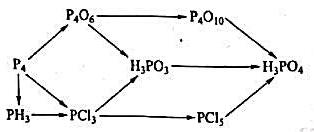
(6)以As2S3为主要原料制备As2O3和H3AsO4。
(7)由Sb2S3矿生产单质Sb。
(8)由Bi2S3制备NaBiO3。
在某密闭容器中加入相同物质的量的NO和Cl2在一定温度下发生下列反应:
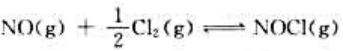
达到化学平衡时,下列有关各组分气体分压的结论正确的是()。
A、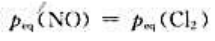
B、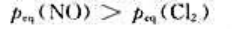
C、
D、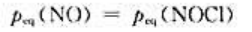
298K时,反应NH2(g)=1/2N2(g)+3/2H2(g)的ΔrGmθ=16.32kJ·mol-1;N2(g)、H2(g)、NH3(g)的标准熵分别为191.0、130.0、191.9J·k·mol-1;三种气体的摩尔定压热容分别为:
