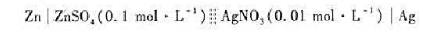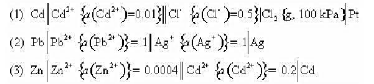更多“计算下列原电池的电动势,写出相应的电池反应.”相关的问题
更多“计算下列原电池的电动势,写出相应的电池反应.”相关的问题
(1)写出下列各电对的电极反应式,并根据元素电势图给出各电极反应的标准电极电势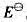 。
。
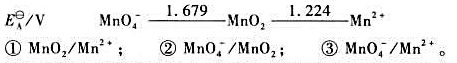
(2)试写出以电对①为负极、电对②为正极的原电池的电池反应,并计算原电池的标准电动势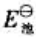 和电池反应的
和电池反应的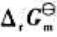 。
。
(3)试写出以电对①为负极、电对③为正极的原电池的电池反应,并计算原电池的标准电动势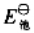 和电池反应的
和电池反应的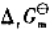 。
。
已知下列原电池:
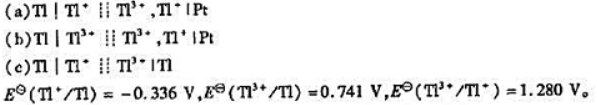
(1)写出各电池反应,并分别指出反应方程式中转移的电子数z;
(2)计算各电池的标准电动势EθMP;
(3)计算各电池反应的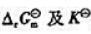 .
.
,它和标准氢电极(作正极)组成原电池,测得其电动势E=0.030V.[已知φθ(Cu2+/Cu)=0.342V]
(1)写出电池反应和原电池符号.
(2)计算[Cu(NH2)4]2+的稳定常数KIθ.
(1)写出原电池符号、电池反应式;
(2)查标准电极电势表,求该原电池的标准电动势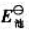 ;
;
(3)当电池反应进行到c(Cu2+)=1.0mol·dm-3时,试计算原电池的电动势E池。
有电对

(1)试分别写出上面电对作为正极和负极时在电池符号中的表示方法。
(2)选用上面的电对,任意组成两种合理的原电池,分别用电池符号表示出来。利用本书附录中标准电极电势表的数据计算电池的电动势并写出其电动势的能斯特方程。
丙烷燃料电池的电极反应为
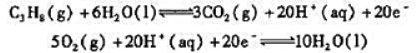
(1)指出正极反应和负极反应;
(2)写出电池反应方程式;
(3)计算25℃下丙烷燃料电池的标准电动势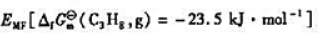
已知铅酸蓄电池
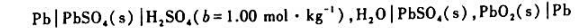
在25°C时的电动势E=1.9283V,Eθ=2.0501V.该电池的电池反应为
Pb(s)+PbO2(s)+2SO42-+4H+→2PbSO4(s)+2H2O
(1)请写出该电池的电极反应;
(2)计算该电池中硫酸溶液的活度a、平均离子活度az及平均离子活度因子γz;
(3) 已知该电池的温度系数为5.664x10-5V·K-1,计算电池反应的ΔrGm,ΔrSm,ΔrHm,
及可逆热Qr,m.
现有KNO3和NaNO2的混合样品5.000g,制备成500.0mL的溶液,移液25.00mL,用浓度为0.1200mol·L-1的Ce4+标准溶液50.00mL在强酸中氧化,过量的Ce4+用浓度为0.02500mol·L-1的Fe2+标准溶液滴定,用去Fe2+溶液28.40mL,相应的反应如下:
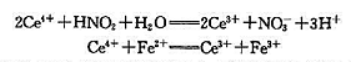
(1)若将第一个反应式作为原电池的电池反应写出该原电池的电极反应并计算该电池反应的ΔrGmθ[已知ϕθ(Ce4++/Ce3+)=1.44V,ϕθ(NO3-/NO2-)=0.934V]
(2)计算试样中NaNO2的质量分数w.[已知M(NaNO2)=69.00g.mol-1]
(3)计算第一步的标准平衡常数Kθ.
解题思路:注意原电池的写法.此题依然是考查电化与热力学、化学平衢间的计算.

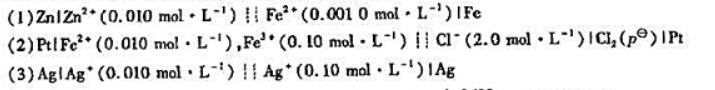

 如果结果不匹配,请
如果结果不匹配,请