 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
分别计算浓度为0.1molkg的CuSO4(y=0.164)和K4Fe(CN)6(y=0.141)的离子平均质量摩尔浓度、离子平均活度以及电解质的活度。
分别计算浓度为0.1molkg的CuSO4(y=0.164)和K4Fe(CN)6(y=0.141)的离子平均质量摩尔浓度、离子平均活度以及电解质的活度。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“分别计算浓度为0.1molkg的CuSO4(y=0.164)…”相关的问题
更多“分别计算浓度为0.1molkg的CuSO4(y=0.164)…”相关的问题
某氯化物溶液100ml,今移取25.00ml溶液3份,用浓度为(0.1057±0.0002)mo/L(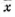 ±S)的AgNO3溶液滴定,分别消耗AgNO3溶液35.15ml,35.22ml和35.19ml,按偶然误差传递规则计算该氯化物溶液中Cl-的量(mmol/L)。
±S)的AgNO3溶液滴定,分别消耗AgNO3溶液35.15ml,35.22ml和35.19ml,按偶然误差传递规则计算该氯化物溶液中Cl-的量(mmol/L)。
下列几种化学试剂均为实验室常用试剂,分别计算它们的物质的量浓度和质丹摩尔浓度.
(1)浓盐酸,含HCI 37.0%,密度1.19 g·cm-1;(2)浓硫酸,含H2SO4,98.0%,密度1.84g·cm-3;(3)浓硝酸,含HNO370.0%,密度1.42 g·cm-3;(4)浓氨水,含NH328.0%,密度0.90 g·cm-3。
的平衡常数.若溶液中NH3和NH4+的浓度均为0.10mol·L-1,则Zn(OH)2溶于该溶液中主要生成哪种配离子?
分别计算Zn(OH)2溶于氨水生成Zn(NH3)42+和生成Zn(OH)42-时的平衡常数。若溶液中NH3和NH4+的浓度均为0.1molL-1,则Zn(OH)2溶于该溶液中主要生成哪一种配离子?