 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
根据周期表中位置关系,运用元素周期律分析下面的推断,其中推断错误的是()
A.氢氧化铍[Be(OH)2]的碱性比氢氧化镁的弱
B.砹(At)为有色固体,HAt不稳定
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
 答案
答案
D、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.氢氧化铍[Be(OH)2]的碱性比氢氧化镁的弱
B.砹(At)为有色固体,HAt不稳定
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
 答案
答案
D、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“根据周期表中位置关系,运用元素周期律分析下面的推断,其中推断…”相关的问题
更多“根据周期表中位置关系,运用元素周期律分析下面的推断,其中推断…”相关的问题
A.Na的原子失去电子能力比Mg强
B.HBr比HCl稳定
C.Ca(OH)2的碱性比Mg(OH)2的碱性强
D.H2SO4比H3PO4酸性强
A.①②
B.①④
C.②③
D.③④
设有元素A、B、C、D、E、G、M,试按下列所给的条件,推断它们的元素符号及在周期表中的位置(周期、族),并写出它们的价层电子构型。
(1) A、B、C为同一周期的金属元素,已知C有三个电子层,它们的原子半径在所属周期中为最大,并且A>B>C;
(2) D、E为非金属元素,与氢化合生成HD和HE,在室温时D的单质为液体,E的单质为固体;
(3) G是所有元素中电负性最大的元素;
(4) M为金属元素,它有四个电子层,它的最高氧化数与氯的最高氧化数相同。
A.铊是易导电的银白色金属
B.能生成+3价离子化合物
C.Tl(OH)3是两性氢氧化物
D.Tl3+的氧化能力比Al3+弱
有人估计具有114个质子和184个中子的原子核可以稳定存在。试推断:
①该元素在元素周期表中的位置;
②该元素的近似相对原子质量;
③该元素的价层电子构型;
④它和哪种元素的性质最相似。
A.气态氢化物的稳定性:H2O>SiH4>NH3
B.氢元素与其他元素可形成共价化合物或离子化合物
C.门捷列夫提出的元素周期律为发现新元素、寻找新材料提供了新思路
D.在元素周期表中,从ⅢB族到ⅡB族的10个纵列中,所有的元素都是金属元素
饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在。
(1)33As与P位为同一主族,磷的原子结构示意图为(),砷在周期表中的位置()。
(2)根据元素周期律,下列说法正确的是()(填字母序号)。
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
C.非金属性:S>P>As
d.还原性:AsH3>PH3>H2S
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水FeS2被O2氧化的离子方程式为()。
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果: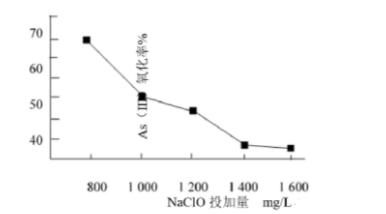 已知:投料前水样PH=5.81mol/LNaClO溶液PH=10.5,溶液中起氧化作用的物质是次氯酸,产生此结果的原因是()。
已知:投料前水样PH=5.81mol/LNaClO溶液PH=10.5,溶液中起氧化作用的物质是次氯酸,产生此结果的原因是()。
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的。已知:一定条件下,As(Ⅴ)的存在形式如下表所示: pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是()。
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是()。
A.元素周期表是元素按原子量大小排列而成的
B.从第一周期到第三周期元素,其原子的价电子数和族数是一致的
C.主族元素中(氢除外)族序数越小的元素,其最高价氧化物的水化物碱性越强
D.元素周期表是元素周期律的具体表现形式