 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
试比较MgSO4, K3[Fe(CN)6],和 AlCl3三种电解质在下列两种情况中凝结值大小的
试比较MgSO4, K3[Fe(CN)6],和 AlCl3三种电解质在下列两种情况中凝结值大小的
顺序。
(1) 0.01mol. L-1AgNO溶液和0.03molL K3CrO4
(1) 0.001mol L-1AgNO3溶液和0.01molLKBr溶液等体积混合制成的AgBr溶胶
(2)0.01molL-1AgNO3溶液和0.001molLKBr溶液等体积混合制成的AgBr溶胶
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“试比较MgSO4, K3[Fe(CN)6],和 AlCl3三…”相关的问题
更多“试比较MgSO4, K3[Fe(CN)6],和 AlCl3三…”相关的问题
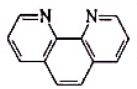 (简写成phen)生成的配位化合物
(简写成phen)生成的配位化合物 0(F-)=13961cm-1,
0(F-)=13961cm-1,
















